
什麼是PIF檔案?
一、 前言
依據「化粧品衛生安全管理法」第四條及「化粧品產品資訊檔案管理辦法」,經中央主管機關公告之化粧品種類及一定規模之化粧品製造或輸入業者,應於化粧品供應、販賣、贈送、公開陳列或提供消費者試用前建立產品資訊檔案(Product Information File, PIF),以確保上市之化粧品經過適當的安全評估,證明該上市之化粧品可被安全使用,並將產品資訊檔案存放於產品標示之地址,以供主管機關查核。
二、 目的
建置產品資訊檔案涉及化粧品製造或輸入業者、製造場所、原物料供應商以及安全資料簽署人員,為協助業者理解產品資訊檔案管理制度,特擬此文件提供產品資訊檔案製作之基本原則及注意事項,作為業者建立產品資訊檔案之參考文件。
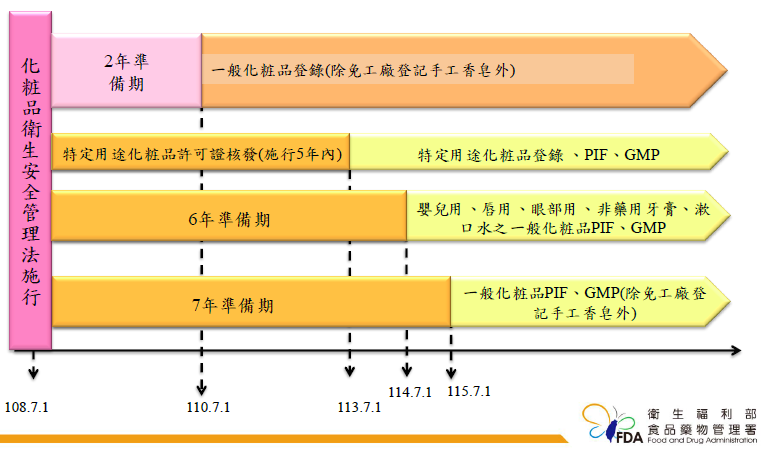
衛生福利部食品藥物管理署(簡稱 TFDA)於 108 年 7 月 1 日起施行「「化粧品產品資訊檔案管理辦法」。
其中明訂誰需要做簽署化粧品產品資訊檔案:
第 二 條 本法第四條第一項所定一定規模之化粧品製造或輸入業者(以下簡稱化粧品製造或輸入業者),指經營化粧品製造或輸入之下列對象:
一、依公司法、商業登記法,應辦理設立登記之公司或商號。
二、依本法第八條第一項規定,應完成登記之工廠。
三、除免工廠登記之手工香皂業者外,非屬前二款之其他製造或輸入化粧品之團體或法人
同時載明化粧品產品資訊檔案應包含的內容:
第 三 條 化粧品產品資訊檔案,應以中文或英文建立下列資料:
一、產品基本資料:產品名稱、產品類別、劑型、用途、製造廠名稱與地址及產品製造或輸入業者資訊。
二、完成產品登錄之證明文件。
三、全成分名稱及其各別含量。
四、產品標籤、仿單、外包裝或容器。
五、製造場所符合化粧品優良製造準則之證明文件或聲明書。
六、製造方法、流程。
七、使用方法、部位、用量、頻率及族群。
八、產品使用不良反應資料。
九、產品及各別成分之物理及化學特性。
十、成分之毒理資料。
十一、產品安定性試驗報告。
十二、微生物檢測報告。
十三、防腐效能試驗報告。
十四、功能評估佐證資料。
十五、與產品接觸之包裝材質資料。
十六、產品安全資料:
(一) 經安全資料簽署人員簽名並載明日期之安全性評估結論及建議。
(二)安全資料簽署人員符合第四條至第六條規定之資格證明文件。
前項檔案原始資料非以中文或英文建立者,應備有中文或英文譯本。化粧品分段製造者,第一項第一款之製造廠名稱及地址,應包括製程中所有製造廠及其執行製程。
第一項資料有變更者,其檔案應更新之。
第一項第十一款至第十三款資料,經安全資料簽署人員依產品屬性或特性評估,且由安全資料簽署人員於同項第十六款產品安全資料敘明理由者,得免建立之。
